|
탐색 건너뛰기 링크입니다.
|
|
images/ %농도[자원전체][과수이야기][EcoWorld]
- 7
- P%=p/100(g/g) m=m (g/mol) d=d/0,001(g/L)
- Mp=M/V(mol/L)
- M=p/m(mol) V=0.001/d 100 (L))=0.1/d(L)
- Mp=M/V=p/m / 0.1/d =10dp/m (mol/L)
- q% bL
- %농도는 질량 백분률
- %농도 = 용질(물질)질량 무게(g)/(수)용액질량 무게(g), 용액(g)=용질(g) + 증류수(g)
- 20% 농도 염산(HCL) = 염산20g / 용액100g(증류수80g + 염산20g)
- 용질의 양(몰)은 변함없다.
- 진한 용액 일정량에다 용매를 가해서 묽은 용액을 만들 때, 즉 용액을 묽힐 때, 묽히기 전/후 용액에 들어있는 용질의 양은변함없다(즉, 일정하다)
- 진한 용액 속의 용질의 몰수 = 묽은 용액 속의 용질의 몰수
- 농도 × 부피 = (mol/L) × L = mol
- 묽힘법칙
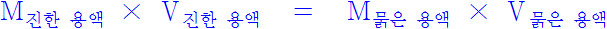
(진한 용액의 농도) (진한 용액의 양) = (묽은 용액의 농도) (묽은 용액의 양)- 즉 진한 용액(용질+용매) 속의 용질의 몰수 = 묽은 용액 속의 용질의 몰수
- 용질의량(몰)은 농도 × 부피 = (mol/L) × L = mol이고
- MV=M'V' =e, M=e/V=e/(e+m) =e/V, M'=e/V'=e/(e+m')
- 예
- M=%농도, V=질량 으로도 성립한다.
- 85%시약 몇질량 Mg으로 5%의 용액 500g을 만들수 있나?
- MV=M'V' => 85M=5x500 => M=5x500/85=29.4 g, 85%시약 29.4g + 물 470.6g=5농도의 용액 용액500g이 된다.
- 85%시약 몇 mL로 5%의 용액 500 mL을 만들수 있나?
- 묽힘법칙
- CVD=cvd 용질의질량은 용액의부피에에 무관하게 일정하다.
- C : 용액의 퍼센트농도, V:용액의 부피, D : 용액의 밀도
- c=5%, v=500(mL), d=1.0255(g/ML)
- 몰농도
- 0.1 M(몰)농도(0.1mol/L)의 포도당용액 만들기
- 몰 = 입자수 / L , 1L 부피에 포함된 입자수
- 0.1 M의 포도당용액 = 0.1mol의 포도당과 물을 희석하여 만들어지는 1L의용액이다.
- 포도당 시약병 1mol의무게 180g/mol가 표기되어있다. 따라서 포도당 0.1mol은 18g의 포도당이다.
- 0.1 M의 포도당용액 = 18g의 포도당과 물을 희석하여 만들어지는 1L의용액이다.
- 0.1M(mol) 염산 수용액 만들기
- 10M의 염산용액이 있다면 있다면
- 100배 희석해서 만든다.
0.M 염산 수용액 1L = 10mL염산 + 990mL 물
- 36.5% 염산용액이 있다면
- 36.5% 염산용액 = 염산36.5g/100g용액(염산36.5g+물64.5g)
- 염산의 물질량 36.5g/mol이므로 36.5%염산 100g에 1 mol염산이 들어있는 셈이다.
- 밀도가 1.2g/mL이라면, 포도당 시약병에 밀도(~비중)=물질의 질량/차지하는부피(mL)=g/mL가 /표기되어있다.
- 1.2(g) :1(mL)= 100g : V(ml)=100(g mL)/1.2(g)=83.33(mL)
- 36.5% 염산용액 100g(88.33mL)속에는 36.5g(1mol)의 염산이 들어있다.
- 염산의 몰 농도[mol/L) = 1(mol)/0.0833(l)=12M(moll/L)
- 36.5% 염산용액은 몰농도 12M의 염산용액과 같다.
- 공식
- 용질의 밀도 : d(g/ML), 퍼센트농도 p%의 몰농도는 ? (단 용질의 물질량은 Mw(g/mol)이다)
M=10xdxp / Mw
=10 x 1.2 x 36.5 / 26.5 =12
- 몰농도 12M 염산용액으로 몰농도 0.1M 염산용액 500mL는 ?
- 필요한 염산의 몰수 = 0.1M(mol/L) x 0.5(L)=0.05 mol, V=?
- 0.05 = 12 (mol/L) x V(L), V(L)=0.05/12=4.17x10^(-3) L = 4.17mL(0.05 mol)
- 12M 염산용액(원액) 4.17mL(0.05mol)과 물을 서썩어 500mL을 만든다.
LIST TOP
|